Yazarlar: Peter Arlett, Denise Umuhire, Patrice Verpillat ve diğerleri
Yayınlanma Tarihi: 14 Şubat 2025
Kaynak: Clinical Pharmacology & Therapeutics
Mevcut uygulamalar üzerine inşa ederek, Arlett ve arkadaşları (2025), 2030 yılına kadar klinik kanıt oluşturmanın daha fazla hasta sesi tarafından yönlendirileceği ve mevcut veri ve bilgilerden bilgilendirileceği bir vizyon ortaya koymaktadır.. Araştırma tasarımının ele alınacak sorular tarafından yönlendirileceği, klinik denemelerin daha etkin ve etkileyici hale geleceği, gerçek dünya kanıtlarının (RWE) mümkün kılınacağı ve değerinin tam olarak anlaşılacağı, ve şeffaflık aracılığıyla güvenin tesis edileceği öngörülmektedir (Arlett et al., 2025).
İlaçların geliştirilmesi, ruhsatlandırılması, geri ödemesi, kullanımı ve izlenmesi üzerine alınan her kararın merkezinde, klinik kanıtların mükemmelliği yer almaktadır. Sağlık karar vericileri sürekli olarak, toplumu ve hastaları ağır bir yük altına sokan karşılanmamış tıbbi ihtiyaçlarla yüzleşmektedir. Ancak, ilaç geliştirme sürecinin yavaşlığı ve yüksek maliyeti, ihtiyaç duyan hastalara yeni tedavilerin ulaşmasını engellemektedir (Arlett et al., 2025).
Avrupa’daki sağlık alanı evrim geçirmekte olup, mevcut faktörlerin bir araya gelmesi, klinik kanıt oluşturma sürecine daha güçlü ve daha sürdürülebilir bir yaklaşım getirme fırsatı sunmaktadır. COVID-19 pandemisi, paydaşlar arasında daha iyi işbirliği ve farklı kanıt oluşturma ve değerlendirme yaklaşımlarının potansiyelini ortaya koymuştur. Avrupa’da değişen politika ortamı, Avrupa Sağlık Veri Alanı (EHDS) ve AB ilaç mevzuatında yapılan reform gibi yeni yasalar, daha büyük sağlık verilerine erişim, çalışma tasarımlarında yenilik ve ileri analitik tekniklerin kullanımı yoluyla fırsatlar sunmaktadır. Hastaların kanıt planlaması ve sağlıkta karar verme süreçlerinin tüm yönleriyle daha fazla ilgilenmesi, ilaç geliştirme süreçlerini daha da güçlendirecektir (Arlett et al., 2025).
Arlett ve ekibi, mükemmel klinik kanıtlar üretmek için altı rehber ilkeyi öne sürmüştür. Bunlar arasında, hastaların klinik kanıt oluşturma sürecinin merkezinde yer alması ve her adımda rehberlik etmesi; mevcut veri ve bilgilerin, tanımlanacak boşlukların belirlenmesi, klinik kanıtların oluşturulması ve sağlık kararlarının alınmasında kullanılması; kanıt boşluklarının, araştırma sorularını net bir şekilde formüle edilmesi; veri ve yöntemlerin tam spektrumunun kavranması; klinik kanıtların oluşturulmasının daha erken ve işbirlikçi bir şekilde planlanması; ve yüksek düzeyde şeffaflığın toplumsal güveni pekiştirmesi yer almaktadır (Arlett et al., 2025).
Sonuç olarak, Arlett ve arkadaşlarının (2025) belirttiği üzere, bu ilkelerin uygulanması, Avrupa’da Ar-Ge’nin verimliliğini ve etkinliğini artıracak, ilaçların daha hızlı bir şekilde ihtiyaç duyanlara ulaşmasına yardımcı olacak ve AB’yi klinik araştırmalar için bir merkez haline getirecektir.
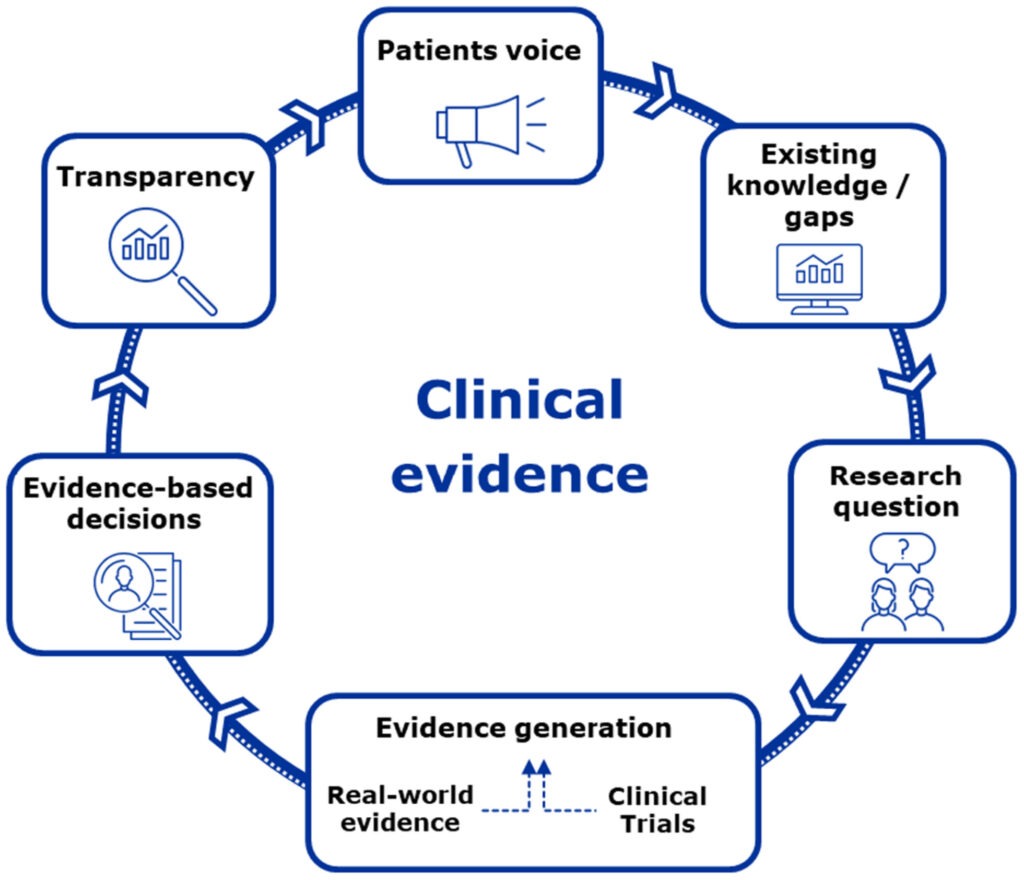
1-Hastaların Rolü: Klinik kanıt oluşturma sürecinde hastaların merkezi bir rol oynaması, ihtiyaçları ve görüşleri doğrultusunda sağlık kararlarının şekillendirilmesi.
2-Mevcut Veri ve Bilgilerin Kullanımı: Araştırma sorularını ve çalışma tasarımlarını şekillendirmede mevcut veri ve bilgilerden yararlanılması, bilgi birikiminin optimal kullanımı.
3-Araştırma Sorularının Netleştirilmesi: Araştırma sorularının açıkça formüle edilmesi ve bu soruların klinik kanıt oluşturma sürecini yönlendirmesi.
4-Veri ve Yöntem Çeşitliliği: Klinik deneyler ve gerçek dünya verileri dahil olmak üzere çeşitli veri kaynakları ve metodolojilerin kullanılması.
5-Erken ve İşbirlikçi Planlama: Klinik kanıtların oluşturulması sürecinin erken aşamada ve sağlık sektöründeki çeşitli paydaşlarla işbirliği içinde planlanması.
6-Şeffaflık ve Güven: Süreçlerin şeffaf bir şekilde yürütülmesi, bu sayede toplumun ve sektör paydaşlarının güveninin artırılması.
Bu maddeler, makalede vurgulanan ana ilkeleri temsil ediyor ve 2030 yılına kadar klinik kanıt oluşturma süreçlerinde önemli iyileştirmeler yapılmasını öngörüyor. Makale, bu iyileştirmelerin hastalar için daha hızlı ve etkili tedavi yöntemlerinin geliştirilmesine olanak tanıyacağını ve Avrupa’nın klinik araştırmalar alanında öncü bir merkez haline geleceğini öne sürüyor.
2030 yılı itibarıyla klinik kanıt oluşturmanın hasta odaklı olarak daha fazla yönlendirilmesi, mevcut veriler ve bilgiyle bilgilendirilmesi; araştırma sorularının ele alınmasına dayalı bir çalışma tasarımının yapılması; klinik denemelerin daha verimli ve etkili hale gelmesi; gerçek dünya kanıtlarının (RWE) desteklenmesi ve değerinin tam olarak belirlenmesi; güvenin şeffaflık yoluyla oluşturulmasıdır.
Klinik Kanıt 2030 Makalesi
Klinik kanıtın mükemmelliği, ilaçların geliştirilmesi, onaylanması, geri ödemesi, kullanımı ve izlenmesi ile ilgili her iyi bilgilendirilmiş kararın merkezindedir.
Sağlık karar vericileri, hastalar ve toplum üzerinde büyük bir yük oluşturan karşılanmamış tıbbi ihtiyaçlarla karşılaşmaya devam ederken, ilaç geliştirilmesinin yavaş hızı ve yüksek maliyeti, yeni tedavilerin ihtiyacı olan hastalara ulaşmasını engellemektedir.
Ancak Avrupa’daki sağlık perspektifi değişiyor ve birkaç faktörün birleşmesi, klinik kanıt üretimine daha güçlü ve sürdürülebilir bir yaklaşım sağlama fırsatı sunuyor. COVID-19 pandemisi, yeni çalışma yöntemlerinin potansiyelini göstermiştir; bu, paydaşlar arasında daha iyi işbirliği ve kanıt üretimi ile değerlendirilmesine yönelik farklı yaklaşımlar içermektedir. Avrupa’daki değişen politika ortamı, Avrupa Sağlık Verisi Alanı (EHDS) üzerine yeni mevzuat ve AB ilaç düzenlemelerinin reformu gibi fırsatlar sunarak, daha geniş sağlık verisi erişimi, yenilikçi çalışma tasarımları ve gelişmiş analizlerin kullanılmasına olanak tanımaktadır. Hasta katılımının her aşamada artması, ilaç geliştirmeyi daha da güçlendirecektir.
Aşağıda mükemmel klinik kanıt üretimi için altı temel ilke vurgulanmaktadır.
İlke 1: HASTALAR KLİNİK KANIT ÜRETİMİNİN MERKEZİNDEDİR VE HER AŞAMAYI YÖNLENDİRİR
Klinik kanıt, hastaların ihtiyaçları ve halk sağlığı için üretilmektedir. Hasta katılımı sayesinde, hastalar, tıbbi ihtiyaçları ve sağlık kararlarıyla ilgili kendilerine gerçekten önemli olan konularda kritik bilgiler sağlar. Klinik kanıt üretimi, bu ihtiyaçlar etrafında şekillenmelidir. Hastalar, ilaçların fayda-risk değerlendirmelerine dahil olan sağlık kararlarında, kişisel deneyimlerini, bilgi ve uzmanlıklarını, hem hastalıklar hem de mevcut tedavi seçenekleri üzerine sunmuşlardır ve bu kararların yaşamları üzerindeki etkilerini de ele almışlardır.
Bu çabalar, hasta deneyimi verilerinin ilaçların geliştirilmesi ve fayda-risk değerlendirmeleri üzerine alınan kararları desteklemek için toplanması ve kullanılmasını yönlendirmeye devam etmektedir. Bu çabaların üzerine daha fazla ilerleme sağlanması için bu alanda çok paydaşlı işbirliği teşvik edilmektedir.
İlke 2: MEVCUT VERİLER VE BİLGİLER, KLİNİK KANIT ÜRETİMİ VE SAĞLIK KARARLARINI YÖNLENDİRMEK İÇİN KULLANILIR
Klinik kanıt üretimi, amaç, veri, bilgi ve uzmanlık tarafından rehberlik edilerek planlanır. Araştırma soruları formüle edilirken ve klinik kanıt programları tasarlanırken, mevcut veriler, bilgiler ve bilgiler kullanılmalıdır. Şu anda bu her zaman yapılmamaktadır ve klinik çalışmalar, önceki çalışma sonuçlarından ya da diğer tıbbi ürünlerden elde edilen öğrenimlerden habersiz olarak planlanabilmektedir. Bu bilgiyle yönlendirilen klinik araştırmayı mümkün kılmak için, veri, bilgi ve bilgilere, araştırma protokollerine ve sonuçlarına, şüpheli advers reaksiyon raporlarına ve düzenleyici değerlendirmelerin sonuçlarına erişimin kamuya açık hale getirilmesi ve çalışmalar tasarlanırken bu bilgilerin incelenmesi gerekir. Planlama aşamasında çok paydaşlı diyalog da mevcut bilgilere erişimi kolaylaştıracaktır. Bu şekilde, geçmiş başarılar ve başarısızlıklar, boşlukların tespit edilmesine ve ek klinik kanıt üretimine rehberlik edebilir ve gereksiz çoğaltmaları engelleyebilir.
İlke 3: KANIT BOŞLUKLARI, AÇIK ARAŞTIRMA SORULARI OLARAK FORMÜLE EDİLİR VE KANIT ÜRETİMİNİ YÖNLENDİRİR
Bir “araştırma sorusu”na dayalı bir yaklaşım, bir veya birkaç araştırma sorusu açıkça dile getirilerek klinik kanıt üretimini güçlendirir. Bu yaklaşım, uygun çalışma yöntemlerinin seçilmesini sağlamalıdır; bazı sorular, deneyler (klinik denemeler dahil) yoluyla, diğerleri ise gözlemler (müdahale olmayan çalışmalar dahil, gözlemsel çalışmalar) yoluyla daha iyi yanıtlanabilir.
Bilimsel tavsiye ve düzenleyici destek, araştırma ve geliştirmede (Ar-Ge) daha iyi kanıt üretimi için önemlidir ve daha da güçlendirilmelidir.
İlke 4: VERİLERİN VE YÖNTEMLERİN TAM SPEKTRUMU KABUL EDİLİR, DAHA İYİ, DAHA AKILLICA VE DAHA HIZLI KLİNİK DENEMELER, GERÇEK DÜNYA KANITLARIYLA TAMAMLANIR
Araştırma soruları, kanıt üretimi için veri ve yöntemlerin seçimini yönlendirir ve tüm kanıtlar, karar verme süreçlerinde sistematik olarak değerlendirilir.
İlke 5: KLİNİK KANIT ÜRETİMİ DAHA ERKEN VE SAĞLIK HİZMETLERİ PAYDAŞLARI ARASINDA İŞBİRLİĞİYLE PLANLANIR, TAM KANIT TOPLAMININ TAM KULLANILMASINA OLANAK TANIR
Klinik kanıt stratejisinin erken ve entegre edilmiş şekilde planlanması, sağlık kararları verme sürecindeki tüm paydaşların, üretilen klinik kanıt toplamını tam olarak kullanabilmelerini sağlamak için kritik öneme sahiptir. Bu, farklı paydaşların hasta ve bakım verenlerinin karşılanmamış tıbbi ihtiyaçları nasıl tespit ettiğini, ilaç geliştiricilerin bu ihtiyaçları Ar-Ge planına nasıl çevirdiğini, bu planın nasıl bilimsel tavsiyelerle, düzenleyiciler ve sağlık teknolojisi değerlendirme (HTA) organları tarafından gözden geçirildiğini ve bu gözden geçirilmiş planın klinik denemeler, RWD ve hasta deneyimi verilerinin analizlerine nasıl rehberlik ettiğini anlayarak başlamak için yakın işbirliği gerektirir.
Sonuç olarak, bu ilkelerin şeffaf ve işbirlikçi bir şekilde uygulanması, tüm paydaşların, özellikle hastaların ve sağlık profesyonellerinin katılımını ve katkı sağlama istekliliğini güçlendirecektir. Tüm paydaşlar, kanıtların, toplumun kararlarını desteklemek için gereken standart seviyelere ulaşmasını sağlamak konusunda kolektif bir sorumluluğa sahiptir. Klinik kanıtlar, daha hızlı şekilde daha iyi ilaçların hastalara ulaşmasını sağlamak için güvenilen, güçlü ve etkili bir araç haline gelir.
SONUÇ Bu altı ilkenin klinik kanıt üretimi için uygulanması, Avrupa’da Ar-Ge verimliliğini ve etkinliğini artıracak; ilaçları ihtiyacı olan hastalara daha hızlı ulaştırmaya yardımcı olacak ve Avrupa’yı klinik araştırmalar için bir merkez haline getirecektir. Bu ilkelerin uygulanması, hastaları güçlendirecek; daha iyi veri odaklı kararlar alınmasını sağlayacak, çoklu karar alıcıların ihtiyaçlarını karşılayacak ve nihayetinde mükemmel klinik kanıtlara yol açacaktı

