| Bakanlığın Adı | : | Sağlık Bakanlığından: |
| Tebliğin Adı | : | Kozmetik Ürün Bileşimlerinin Kontrolü İçin Gerekli Analiz Yöntemleri Hakkında Tebliğ (Tebliğ No:İEG-2005/6) |
| Tebliğ No | : | İEG-2005/6 |
| R. Gazete Tarihi | : | 01/07/2005 |
| R. Gazete Sayısı | : | 25862 |
KOZMETİK ÜRÜN BİLEŞİMLERİNİN KONTROLÜ İÇİN GEREKLİ ANALİZ YÖNTEMLERİ HAKKINDA TEBLİĞ
TEBLİĞ NO:İEG-2005/6
Amaç
Madde 1- Bu Tebliğin amacı, benzoik asit, 4-hidroksibenzoik asit, sorbik asit, salisilik asit ve propionik asit tanı ve tayini, hidrokinon, hidrokinon monometileter, hidrokinon monometileter ve hidronon monobenzileter tanı ve tayini konularındaki analiz yöntemleri ile ilgili usul ve esasları belirlemektir.
Kapsam
Madde 2- Bu Tebliğ, aşağıdaki analiz metodlarının uygulamalarını kapsar:
a)Benzoik asit, 4-hidroksibenzoik asit, sorbik asit, salisilik asit ve propionik asit tanı ve tayini EK’teki Yöntem I’e göre yapılır.
b)Hidrokinon, hidrokinon monometileter, hidrokinon monometileter ve hidronon monobenzileter tanı ve tayini EK’teki Yöntem II’ye göre yapılır.
Hukuki Dayanak
Madde 3 – Bu Tebliğ, 23/5/2005 tarihli ve 25823 sayılı Resmi Gazete’de yayımlanan Kozmetik Yönetmeliği’nin 16 ncı maddesine dayanılarak hazırlanmıştır.
Uyumlaştırılan Avrupa Birliği Mevzuatı
Madde 4- Bu Tebliğ, 95/32/EEC sayılı Kozmetik Ürün Bileşimlerinin Kontrolü İçin Gerekli Analiz Yöntemleri Hakkında Altıncı Komisyon Direktifi dikkate alınarak, Avrupa Birliği mevzuatına uyum kapsamında hazırlanmıştır. Bu Tebliğ, laboratuarların denenmiş ve bilimsel geçerliliği olan yöntemleri kullanmasını engellemez.
Yürürlük
Madde 5- Bu Tebliğ yayımı tarihinde yürürlüğe girer.
Yürütme
Madde 6- Bu Tebliğ hükümlerini Sağlık Bakanı yürütür.
EK
YÖNTEM I- KOZMETİK ÜRÜNLERDE BENZOİK ASİT, 4-HİDROKSİBENZOİK ASİT,SORBİK ASİT, SALİSİLİK ASİT VE PROPİYONİK ASİT TANI VE TAYİNİ
1.KAPSAM VE UYGULAMA ALANI
Bu metod benzoik asit, 4-hidroksibenzoik asit, sorbik asit, salisilik asit ve propiyonik asidin kozmetik ürünlerde tanı ve tayini için uygulanır. Bu koruyucuların tanımlanması için ayrı prosedürler verilmiştir. Propiyonik asit tayini ve 4-hidroksibenzoik asit, salisilik asit, sorbik asit, benzoik asit tayini.
2. TANIM
Bu metod ile benzoik asit, 4-hidroksibenzoik asit, sorbik asit, salisilik asit, ve propiyonik asit miktarı serbest asitlerin yüzde kütlesi olarak ifade edilir.
A. TANI
1. PRENSİP
Koruyucuların asit / baz ekstraksiyonundan sonra ekstrakt ince tabaka kromatografisiyle (türevlendirme ile) analizlenir. Sonuçlara göre tanılar yüksek basınçlı sıvı kromatografi (HPLC) ile veya propiyonik asitte olduğu gibi gaz kromatografisi (GC) ile doğrulanır.
2. REAKTİFLER
2.1. Genel
Bütün çözeltiler analitik saflıkta olmalıdır. Kullanılan su damıtılmış su veya en az eşdeğer bir saflıkta olmalıdır.
2.2. Aseton
2.3. Dietileter
2.4. Asetonitril
2.5. Toluen
2.6. n-hekzan
2.7. Sıvı parafin
2.8. Hidroklorik asit 4 M
2.9. Potasyum hidroksit, sulu, 4 M
2.10. Kalsiyum klorür, CaCl2.2H2O
2.11. Lityum karbonat Li2CO3
2.12. 2-bromo-2-asetonafton
2.13. 4-hidroksi benzoik asit
2.14. Salisilik asit
2.15. Benzoik asit
2.16. Sorbik asit
2.17. Propionik asit
2.18. Referans solüsyonlar
Beş koruyucunun (2.13-2.17) dietil eterde % 0.1’lik (m/v) solüsyonları (100 mg/100 ml) hazırlanır.
2.19. Türevlendirme reaktifi
2-bromo-2’-asetofenon’un (2.12) asetonitril (2.4) içindeki % 0.5’lik (m/v) solüsyonu (50 mg/10 ml). Bu solüsyon haftalık hazırlanır ve buzdolabında saklanır.
2.20. Katalizör solüsyon
Lityum karbonatın (2.11) suda % 0.3’lük (m/v) solüsyonu (300 mg/100 ml). Bu solüsyon taze hazırlanmalıdır.
2.21. Yürütme solvanı
Toluen (2.5) / aseton (2.2) (20:0.5, v/v)
2.22. Sıvı parafin (2.7) / n-hekzan (2.6) (1:2, v/v)
3. DÜZENEK
Normal laboratuvar düzenekleri
3.1. Su banyosu, 60oC’de tutulabilen
3.2. Yürütme tankı
3.3. Ultraviyole ışık kaynağı, 254 ve 366 nm
3.4. İnce tabaka plakları Kieselgel 60, floresans indikatörü olmayan 20 x 20 cm, kaplama kalınlığı 0.25 mm. 2.5 x 20 cm’lik konsantre edici alan ile (Merck 11845 veya eşdeğeri)
3.5. Mikro şırınga, 10 µl
3.6. Mikro şırınga, 25 µl
3.7. Etüv, 105oC’ye kadar ısınabilen
3.8. Vidalı kapaklı 50 ml.lik cam tüp
3.9. Filtre kağıdı, çap 90 mm, Schleicher & Schull, Weissband No 5892 veya eşdeğeri
3.10. Universal pH indikatör kağıdı, pH 1-11
3.11. 5 ml cam örnek şişeleri
3.12. Döner evaporatör (Rotavapor veya eşdeğeri)
3.13. Isıtıcı tabla
4. İŞLEM
4.1. Örnek hazırlama
Yaklaşık 1 gr örnek vidalı kapaklı (3.8) 50 ml.lik tüp içine tartılır. Dört damla 4 M hidroklorik asit (2.8) ve 40 ml aseton (2.2) ilave edilir. Tuvalet sabunları gibi kuvvetli bazik ürünler için 20 damla hidroklorik asit 4 M (2.8) ilave edilmelidir. İndikatör kağıdı (3.10) kullanılarak pH’ın yaklaşık 2 olduğu kontrol edilir. Tüp kapatılır ve bir dakika süre ile şiddetlice çalkalanır.
Koruyucuların aseton fazına geçişini kolaylaştırmak, likit fazı eritmek için karışım dikkatlice 60oC’ye ısıtılır.
Solüsyon oda ısısına kadar soğutulur ve filtre kağıdı ile (3.9) erlene süzülür.
Filtratın 20 ml’si 200 ml.lik erlene alınır, 20 ml su eklenip karıştırılır. 4 MPotasyum hidroksit (2.9) ile karışımın pH’sı 10 civarına pH kağıdı (3.10) ile ayarlanır.
1 gr kalsiyum klorür (2.10) eklenir ve şiddetle çalkalanır. 75 ml dietil eter (2.3) içeren 250 ml.lik ayırma hunisine süzülerek alınır ve bir dakika şiddetle çalkalanır. Ayrılmaya bırakılır, sulu faz 250 ml.lik erlene aktarılır. Eter tabakası atılır. İndikatör kağıdı (3.10) kullanılarak, sulu solüsyonun pH’sı 2 civarına 4 Mhidroklorik asit (2.8) ile ayarlanır. 10 ml dietil eter (2.3) eklenir, erlenin ağzı kapatılarak 1 dakika şiddetle çalkalanır. Ayrılması beklenir ve eter tabakası döner evaporatöre (3.12) aktarılır. Sulu kısım atılır.
Eterli faz hemen hemen kuruluğa kadar uçurulur ve kalıntı 1 ml dietil eter (2.3) içinde çözülür, solüsyon örnek şişesine (3.11) alınır.
4.2. İnce tabaka kromatografisi
Kromatografi uygulanacak her referans ve örnek için, TLC plağına 3 µl lityum karbonat çözeltisi (2.20), mikro şırınga (3.5) ile uygulanır. Plak soğuk hava altında kurutulur.
TLC plağı ısıtıcı tabla (3.13) üzerine alınıp, 40oC’ye ısıtılır. Mikro şırınga (3.5) ile 10 µl referans solüsyon (2.18) ve örnek solüsyon (4.1) plağa lityum karbonat damlatılmış olan yerlerin tam üzerine gelecek şekilde damlatılır.
Son olarak yaklaşık 15 µl türevlendirme reaktifi (2.19) (2-bromo-2’-asetonafton solüsyonu), aynı noktalar üzerine tatbik edilir.
TLC plağı 45 dakika süre ile 80oC’lik bir etüvde (3.7) ısıtılır. Soğutulduktan sonra, 15 dakika süre ile solvanla şartlandırılmış (filtre kağıdı konmadan) tanka (3.2) daldırılır. 15 cm’ye kadar yürütme solvanı (2.21) (toluen / aseton) içerisinde yürütülür (Yaklaşık 80 dakika sürer).
Plak soğuk hava akımında kurutulur, ultraviyole (3.3) altında incelenir. Zayıf lekelerin floresansını arıttırmak için plak sıvı parafin / n-hekzan (2.22) karışımına daldırılabilir.
5. TANIM
Her leke için Rf hesaplanır.
Ultraviyole ışığı altında örnek ve referans solüsyonların Rf değerleri karşılaştırılır.
Mevcut koruyucuların varlığı ve niceliği araştırılır. Bölüm B’de tanımlanan HPLC uygulanır veya eğer propiyonik asid’in mevcudiyeti görünüyorsa Bölüm C’de tanımlanan GC uygulanır. Alıkonma süreleri referans solüsyonlarla karşılaştırılır.
TLC ve HPLC veya GC’den alınan sonuçlar birleştirilir. Toplam sonuçlar örnekte var olan koruyucuların kesin teşhisleridir.
B. BENZOİK ASİT, 4-HİDROKSİBENZOİK ASİT, SORBİK ASİT VE SALİSİLİK ASİT TAYİNİ
1. PRENSİP
Asitleştirmeden sonra, örnek, etanol ve su karışımı ile ekstre edilir. Süzülme işleminden sonra koruyucular yüksek basınçlı sıvı kromatografi (HPLC) ile tayin edilir.
2. REAKTİFLER
2.1. Bütün çözeltiler analitik saflıkta olmalı ve HPLC için uygun olmalıdır. Kullanılan su damıtılmış olmalı yada eşdeğer saflıkta olmalıdır.
2.2. Absolu etanol
2.3. 4-hidroksi benzoik asit
2.4. Salisilik asit
2.5. Benzoik asit
2.6. Sorbik asit
2.7. Sodyum asetat (CH4COONa.3H2O)
2.8. Asetik asit (d420= 1.05 g/ml)
2.9. Asetonitril
2.10. Sülfürik asit, 2 M
2.11. Sulu potasyum hidroksit 0.2 M
2.12. 2-metoksibenzoik asit
2.13. Etanol / su karışımı
Dokuz hacim etanol (2.2), bir hacim su ile karıştırılır (2.1).
2.14. İnternal standart solüsyonu
500 ml.lik etanol / su karışımında (2.13) yaklaşık 1 gr 2-metoksi benzoik asit (2.12) ihtiva eden bir solüsyon hazırlanır.
2.15. HPLC için mobil faz
2.15.1. Asetat tampon: 1 litrelik suya 6.35 gr sodyum asetat (2.7) ve 20 ml asetik asit (2.8) ilave edilir ve karıştırılır.
2.15.2. Dokuz hacim asetat tamponu (2.15.1) ve bir hacim asetonitril (2.9) karıştırılarak mobil faz hazırlanır.
2.16. Koruyucu stok solüsyonu
Yaklaşık 0.05 g 4-hidroksibenzoik asit (2.3), 0.2 g salisilik asit (2.4), 0.2 gbenzoik asit (2.5) ve 0.05 g sorbik asit (2.6) 50 ml.lik ölçülü balona tam tartılır. Etanol / su karışımı (2.13) ile hacme tamamlanır. Bu solüsyon buzdolabında saklanır. Bir hafta süreyle stabildir.
2.17. Koruyucu standart solüsyonları
20 ml.lik bir seri ölçülü balon içerisine 8.00, 4.00, 2.00, 1.00 ve 0.50 ml stok solüsyon (2.16) pipetlenir. Her bir ölçülü balon içerisine 10 ml internal standart solüsyon (2.14) ve 0.5 ml sülfürik asit 2 M (2.10) konulur. Etanol / su karışımı (2.13) ile hacme tamamlanır. Bu solüsyonlar taze hazırlanmalıdır.
3. EKİPMAN
Aksi belirtilmedikçe normal laboratuvar düzeneği
3.1. Su banyosu 60oC’ye ayarlanmış
3.2. Yüksek basınçlı sıvı kromatografi, değişken dalga boylu UV dedektörlü ve 10 µl enjeksiyon luplu.
3.3. Analitik kolonu : Paslanmaz çelik
Uzunluk : 12.5-25 cm
İç çap : 4.6 mm, Nucleosil 5C18; veya eşdeğeri ile doldurulmuş.
3.4. Filtre kağıdı
Çap : 90 mm Scleicher ve Schull, Weissband No 5892 veya eşdeğeri
3.5. 50 ml cam tüpler, vidalı kapaklı
3.6. 5 ml cam örnek şişeleri
3.7. Cam boncuklar 2-4 mm ebadında veya eşdeğeri
4. İŞLEM
4.1. Örnek hazırlanması
4.1.1. İnternal standart eklemeden örnek hazırlama
50 ml.lik vidalı kapaklı cam tüp (3.5) içine 1 g örnek tartılır. Sülfürik asit 2 M(2.10) ve 40.0 ml etanol / su karışımı (2.13) pipetlenir. Cam boncuklarından (3.7) 1 g civarında eklenir. Tüp kapatılır ve homojen bir süspansiyon elde edilinceye kadar en az bir dakika boyunca şiddetle çalkalanır. Etanol fazına koruyucuların geçmesini kolaylaştırmak için tüp tam olarak 5 dakika 60oC ısıdaki su banyosuna (3.1) konulur.
Tüp hemen soğuk su altına tutularak soğutulur ve ekstrakt 5oC’de 1 saat saklanır.
Elde edilen ekstrakt filtre kağıdından (3.4) süzülür. Filtre edilen üründen yaklaşık 2 ml örnek şişesine (3.6) aktarılır. Filtrat 5oC’de bekletilir ve 24 saat içinde HPLC ile tayin edilir.
4.1.2. İnternal standart eklenerek örnek hazırlama
50 ml.lik vidalı kapaklı cam tüp (3.5) içerisine örnek 1 ± 0.1 gr (A gram) tartılır. 1 ml 2 M Sülfürik asit (2.10) ve 30 ml etanol / su karışımı (2.13) pipetle ilave edilir. Yaklaşık 1 gr cam boncuk (3.7) ve 10 ml internal standart solüsyonu (2.14) eklenir, tüpün ağzı kapatılır ve homojen bir süspansiyon elde edilinceye kadar en az 1 dakika şiddetle çalkalanır. Koruyucuların etanol fazına geçişini kolaylaştırmak için, tüp 5 dakika 60oC’deki su banyosuna (3.1) yerleştirilir.
Tüp hemen soğuk su altında soğutulur ve ekstrakt 5oC’de 1 saat saklanır.
Ekstrakt filtre kağıdından (3.4) süzülür. Yaklaşık 2 ml filtrat örnek şişesine (3.6) aktarılır. Filtrat 5oC’de saklanır ve 24 saat içerisinde HPLC ile tayin yapılır.
4.2. Yüksek basınçlı sıvı kromatografisi
Mobil faz : Asetonitril / asetat tamponu (2.15)
Akış hızı : 2 ± 0.5 ml/dak.
Dalga boyu : 240 nm
4.2.1. Kalibrasyon
Koruyucu standart solüsyonlarının (2.17) her birinden 10’ar µl enjekte edilir. Kromatogramdan her solüsyona karşı gelen pik yüksekliğinin internal standardın pik yüksekliğine oranı tayin edilir ve her standart solüsyonun konsantrasyonuna karşı grafiğe geçirilir.
Grafikten lineer bir sonuç çıkması gereklidir.
4.2.2. Tayin
Örnek ekstraktından (4.1.1) 10 µl enjekte edilir. Kromatogram kaydedilir. Koruyucu standart solüsyonundan (2.17) 10 µl enjekte edilir, kromatogram kaydedilir. Elde edilen kromatogramlar karşılaştırılır. Eğer örnek ekstraktının (4.1.1) kromatogramında 2-metoksibenzoik aside (önerilen internal standart) karşı gelen alıkonma süresinde bir pik mevcut değilse 10 µl internal standart ilave edilmiş örnek ekstraktı (4.1.2) enjekte edilir ve kromatogram kaydedilir.
Eğer örnek ekstraktı (4.1.1) kromatogramında 2-metoksibenzoik asit ile aynı alıkonma süresinde başka bir pik görünürse uygun başka bir internal standart seçilmelidir. (Eğer koruyuculardan biri kromatogramda mevcut değil ise bu koruyucu internal standart olarak kullanılabilir)
Standart solüsyondan ve örnek solüsyonundan elde edilen kromatogramların aşağıdaki gereklilikleri sağladıklarından emin olunmalıdır.
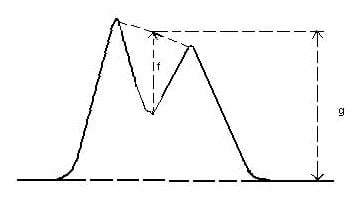
En kötü ayrılmış pik çiftinin ayırımı en az 0.9 olmalıdır (bkz. Şekil 1).
P=f/g | |
| Şekil 1: Pik ayırımı |
Eğer gerekli ayırım elde edilmemişse ya daha etkin bir kolon kullanılmalıdır yada gereklilik elde edilinceye kadar mobil fazın kompozisyonu ayarlanmalıdır.
Elde edilen bütün piklerin asimetri faktörü A 0.9-1.5 arasında olmalıdır. Asimetri faktörü elde etmek için kromatogramlanırken kağıt hızının en az 2 cm/dakika olması önerilir (bkz. Şekil 2).
 | |||||||||||||
|
Düzgün bir baseline (taban çizgisi) elde edilmelidir.
5. HESAPLAMA
Daha önce sözü edilen kalibrasyon grafiğinden örnek solüsyondaki koruyucuların konsantrasyonları hesaplanır. Örnekteki benzoik asit 4-hidroksibenzoik asit, sorbik asit veya salisilik asit miktarı % kütle olarak (Xi) aşağıdaki formül kullanılarak hesaplanır.
| 100 x 20 x b | 106 x a | ||
| Xi%(m/m)= | = | ||
| 500 x a | 500 x a |
Burada:
a = Test miktarının (4.1.2) gram cinsinden kütlesi
b = Kalibrasyon grafiğinden elde edilen örnek ekstraktındaki (4.1.2) µg/ml olarak koruyucu konsantrasyonu.
6. TEKRARLANABİLİRLİK (ISO NORM 5725)
% 0.40’lık bir 4-hidroksibenzoik asit miktarı için aynı örnekteki iki paralel tayin sonucu arasındaki fark % 0.035’i geçmemelidir.
% 0.50’lik bir benzoikasit miktarı için aynı örnekteki iki paralel tayin sonucu arasındaki fark % 0.050’yi geçmemelidir.
% 0.50’lik bir salisilik asit miktarı için aynı örnekteki iki paralel tayin sonucu arasındaki fark % 0.045’i geçmemelidir.
% 0.60’lık bir sorbik asit miktarı için aynı örnekteki iki paralel tayin sonucu arasındaki fark % 0.035’i geçmemelidir.
7. UYARI
7.1 Ekstrakta ilave edilen sülfürik asit miktarı sonuçların hassasiyeti açısından kritiktir. Çalışılan örnek miktarı ve eklenen asit miktarı tarif edilen sınırlar içerisinde kalmalıdır.
7.2 Eğer istenirse uygun bir koruyucu ön kolon kullanılabilir.
C. PROPİYONİK ASİT TAYİNİ
1. KAPSAM VE UYGULAMA ALANI
Bu metod kozmetik ürünlerde maksimum % 2 (m/m) konsantrasyona kadar propiyonik asit tayini için uygundur.
2. TANIM
Üründeki propiyonik asit konsantrasyonu bu metodla % kütle (m/m) cinsinden ifade edilir.
3. PRENSİP
Propiyonik asit üründen ekstre edildikten sonra gaz kromatografisi ile internal standart olarak 2-metilpropiyonik asit kullanılarak tayin edilir.
4. REAKTİFLER
Kullanılan tüm çözeltiler analitik saflıkta olmalıdır. Distile su veya eşdeğer kalitede su kullanılmalıdır.
4.1. Etanol % 96 v/v
4.2. Propiyonik asit
4.3. 2-metil propiyonik asit
4.4. Ortofosforik asit % 10 (m/v)
4.5. Propiyonik asit solüsyonu
1 gr (p gram) propiyonik asit 50 ml etanol (4.1) içinde
4.6. İnternal standart solüsyonu
1 gr (e gram) 2-metil propiyonik asit 50 ml etanol (4.1) içinde
5. EKİPMAN
5.1. Genel laboratuvar ekipmanları
5.2. Alev iyonizasyon dedektörlü gaz kromatografi cihazı
5.3. Vidalı kapaklı cam tüp (20 x 150 mm)
5.4. 60oC’de su banyosu
5.5. Membran filtreli (0.45 µm) 10 ml.lik cam şırınga
6. İŞLEM
6.1. Örnek hazırlama
6.1.1. İnternal standart koymadan örnek hazırlama
Bir cam tüpe (5.3) yaklaşık 1 gr örnek, 0.5 ml fosforik asit (4.4) ve 9.5 ml etanol (4.1) konulur.
Tüp kapatılır ve şiddetle çalkalanır. Eğer gerekiyorsa lipid fazın tamamen çözünmesi için tüp 5 dakika 60oC’deki su banyosuna (5.4) yerleştirilir. Hızlıca su altında soğutulur. Solüsyonun bir kısmı membran filtreden (5.5) süzülür. Filtrat aynı gün kromatograflanır.
6.1.2. İnternal standart ilave ederek örnek hazırlama
1 ± 0.1 gr (a gram) örnek bir cam tüpe (5.3) tartılır. 0.5 ml fosforik asit (4.4), 0.50 ml internal standart solüsyonu (4.6) ve 9 ml etanol (4.1) ilave edilir.
Tüp kapatılır ve şiddetle çalkalanır. Eğer gerekiyorsa lipid fazı çözmek için tüp 5 dakika 60oC’deki su banyosuna (5.4) yerleştirilir. Su altında hızla soğutulur. Solüsyonun bir kısmı membran filtreden (5.5) süzülür, aynı gün kromatograflanır.
6.2. Gaz kromatografi şartları
Aşağıdaki operasyon şartları önerilir.
Kolon
Tip : Paslanmaz çelik
Uzunluk : 2 m
Çap : 1/8”
Ambalaj : % 10 SPTM 1000 (veya eşdeğeri) + % 1 H3PO4
Chromosorb WAW 100-120 mesh
Sıcaklıklar
Enjektör : 200oC
Kolon : 120oC
Dedektör : 200oC
Taşıyıcı Gaz : Azot
Akış hızı : 25 ml/dakika
6.3. Kromatografi
6.3.1. Kalibrasyon
Bir seri 20 ml ölçülü balona 0.25, 0.50, 1.00, 2.00 ve 4.00 ml propiyonik asit solüsyonu (4.5) pipetlenir. Balonlara 1’er ml’de internal standart solüsyon (4.6) pipetlenir. Balonlar etanol (4.1) ile hacme tamamlanır ve karıştırılır. Bu şekilde hazırlanan solüsyonlar e mg/ml 2-metilpropiyonik asit internal standardı içerirler (e= 1000 ise 1 mg/ml’dir.) ve p/4, p/2, p, 2p, 4p mg/ml propiyonik asit (Eğer p= 1000 ise 0.25, 0.50, 1.00, 2.00, 4.00 mg/ml demektir).
Her solüsyondan 1’er µl enjekte edilip, propiyonik asit / 2-metilpropiyonik asit kütle oranları “x” ekseninde ve piklerin oranları “y” ekseninde olmak üzere kalibrasyon eğrisi çizilir.
Ortalama pik alan oranlarını hesaplamak için her solüsyondan 3’er enjeksiyon yapılır.
6.3.2. Tayin
Filtre edilmiş örnekten (6.1.1) 1 µl enjekte edilir. Kromatogramı, standart solüsyonun (6.3.1) kromatogramı ile karşılaştırılır. Eğer bir pik 2-metil propiyonik asit ile aşağı yukarı aynı alıkonma zamanına sahip ise internal standardı değiştirilir. Eğer herhangi bir etkileşim görülmüyor ise 1 µl.lik filtre edilmiş örnekten (6.1.2) enjeksiyon yapılarak, propiyonik asit ve internal standardın pik alanları ölçülür.
Her solüsyondan 3 enjeksiyon yapılarak ortalama pik alan oranı hesaplanır.
7. HESAPLAMA
7.1. 6.3.1.’de elde edilmiş olan kalibrasyon eğrisiden 6.3.2’den hesaplanmış olan pikin alan oranına karşı gelen kütle (K) oranı elde edilir.
7.2. Yukarıdaki şekilde elde edilen kütle oranından örnekteki (X) propiyonik asit miktarı % kütle cinsinden aşağıdaki formülle hesaplanır.
| 0.5 x 100 x e | e | |||
| X % (m/m) = K | = K | |||
| 50 x a | a |
Burada:
K = 7.1’de hesaplanmış olan oran
e = İnternal standardın (4.6) gram olarak kütlesi
a = Örneğin (6.1.2) gram olarak kütlesi
8. TEKRARLANABİLİRLİK (ISO NORM 5725)
% 2’lik (m/m) propiyonik asit miktarı için, aynı örnek üzerinde paralel olarak yapılan iki deney sonucu arasındaki fark % 0.12’yi geçmemelidir.
YÖNTEM II- KOZMETİK ÜRÜNLERDE HİDROKİNON, HİDROKİNON MONOMETİLETER, HİDROKİNON MONOETİLETER VE HİDROKİNON MONOBENZİLETER TANI VE TAYİNİ
A. TANIM
1. KAPSAM VE UYGULAMA ALANI
Bu metod kozmetik ürünler arasında cilt beyazlatılmasında kullanılan ürünlerde hidrokinon, hidrokinon monometileter, hidrokinon monoetileter ve hidrokinon monobenzileter (monobenzon) tanı ve tayinini kapsar.
2. PRENSİP
Hidrokinon ve onun eterleri ince tabaka kromatografisi (TLC) ile tanımlanır.
3. REAKTİFLER
Kullanılan bütün çözeltiler analitik saflıkta olmalıdır.
3.1. Etanol % 96 (v/v)
3.2. Kloroform
3.3. Dietil eter
3.4. Yürütme solvanı
Kloroform / Dietileter, 66:33 (v/v)
3.5. Amonyak, % 25 (m/m) (d420 = 0.91 g/ml)
3.6. Askorbik asit
3.7. Hidrokinon
3.8. Hidrokinon monometileter
3.9. Hidrokinon monoetileter
3.10. Hidrokinon monobenzileter (monobenzon)
3.11. Referans solüsyonlar
Aşağıdaki referans solüsyonlar günlük hazırlanmalıdır ve bir gün stabildirler.
3.11.1. 10 ml.lik dereceli tüpe 0.05 g hidrokinon (3.7) tartılır. Üzerine 0.250 gaskorbik asit (3.6) ve 5 ml etanol (3.1) ilave edilir. Amonyak (3.5) ile pH 10’a ayarlanır. Etanol (3.1) ile hacme tamamlanır.
3.11.2. 10 ml.lik dereceli tüpe 0.05 g hidrokinon monometileter (3.8) tartılır. Üzerine 0.250 g askorbik asit (3.6) ve 5 ml etanol (3.1) eklenir. Amonyak (3.5) ile pH 10’a ayarlanır. Etanol (3.1) ile hacme tamamlanır.
3.11.3. 10 ml.lik dereceli tüpe 0.05 g hidrokinon monoetileter (3.9) tartılır. Üzerine 0.250 g askorbik asit (3.6) ve 5 ml etanol (3.1) eklenir. Amonyak (3.5) ile pH 10’a ayarlanır. Etanol (3.1) ile hacme tamamlanır.
3.11.4. 10 ml.lik dereceli tüpe 0.05 g hidrokinon monobenzileter (3.10) tartılır. Üzerine 0.250 g askorbik asit (3.6) ve 5 ml etanol (3.1) eklenir. Amonyak (3.5) ile pH 10’a ayarlanır. Etanol (3.1) ile hacme tamamlanır.
3.12. Gümüş nitrat
3.13. 12-molibdofosforik asit
3.14. Potasyum ferrisiyanür hekzahidrat
3.15. Ferri klorür, hekzahidrat
3.16. Sprey reaktiflerleri
3.16.1. % 5’lik sulu gümüş nitrat (3.12) solüsyonuna oluşan çökelek çözününceye kadar amonyak (3.5) ilave edilir.
Dikkat: Solüsyon bekletildiğinde stabil olmadığından patlama riski vardır. Kullanıldıktan sonra atılmalıdır.
3.16.2. % 10’luk (m/v) 12-molibdofosforik asidin (3.13) etanol (3.1) içindeki solüsyonu
3.16.3. % 1’lik (m/v) potasyum ferrisiyanür (3.14) ve % 2’lik (m/v) ferri klorür (3.15) sulu solüsyonları hazırlanır. Kullanmadan önce bu solüsyonlar eşit hacimde karıştırılır.
4. DÜZENEK
Normal laboratuvar ekipmanları
4.1. Genel TLC düzenekleri
4.2. TLC hazır plak; silika jel GHR / UV254; 20 x 20 cm (Machery, Nagel veya eşdeğeri) kaplama kalınlığı0.25 mm
4.3. Ultrasonik banyo
4.4. Santrifüj
4.5. UV lamba, 254 nm
5. İŞLEM
5.1. Örnek hazırlama
10 ml.lik ölçülü tüp içine 3 g örnek tartılır. Üzerine 0.250 g askorbik asit (3.6) ve 5 ml etanol (3.1) eklenir. PH, amonyak (3.5) ile 10’a ayarlanır. Etanol (3.1) ile hacme tamamlanır. Tüp kapatılır ve ultrasonik banyoda 10 dakika homojen hale getirilir. 3000 dev/dak.’da santrifüjlenir veya süzgeç kağıdından süzülür.
5.2. TLC
5.2.1. Kromatografi tankı, yürütme solvanı (3.4) ile doyurulur.
5.2.2. Plağa referans solüsyondan (3.11) 2 µl ve örnek solüsyondan (5.1) 2 µl uygulanır. Karanlıkta ve oda ısısında 15 cm yürütülür.
5.2.3. Tanktan çıkartılan plak oda sıcaklığında kurutulur.
5.3. Tespit
5.3.1. Plak 254 nm UV ışığı altında incelenir ve noktaların yerleri işaretlenir.
5.3.2. Plak spreylenir:
– Gümüş nitrat reaktifi (3.16.1) veya
– 12-molibdofosforik asit reaktifi (3.16.2), yaklaşık 120oC’ye kadar ısıtılır
veya
– Potasyum ferrisiyanür solüsyonu veya ferri klorür solüsyonu (3.16.3)
6. TANI
Her nokta için Rf değerleri hesaplanır.
Örnek solüsyon noktaları ile referans solüsyon noktalarının Rf’leri UV ışığı altındaki renkler açısından ve püskürtme reaktifi ile belirgin hale gelen noktaların renkleri açısından karşılaştırılır.
Bundan sonraki kısımda (B) tarif edilen HPLC uygulanır. Örnek pikleri ile referans solüsyon piklerinin alıkonma süreleri karşılaştırılır.
Hidrokinon ve / veya eterlerinin varlığını saptamak için TLC ve HPLC’nin sonuçları birleştirilir.
7. UYARI
Belirtilen şartlar altında aşağıdaki Rf değerleri gözlenmiştir.
Hidrokinon 0.32
Hidrokinon monometileter 0.53
Hidrokinon monoetileter 0.55
Hidrokinon monobenzileter 0.58
B. TAYİN
1. KAPSAM VE UYGULAMA ALANI
Bu metod kozmetik ürünler arasında cilt beyazlatılmasında kullanılan ürünlerde hidrokinon, hidrokinon monometileter, hidrokinon monoetileter, hidrokinon monobenzileter tayinini kapsar.
2. PRENSİP
Örnek içindeki lipid maddeleri eritmek için su / metanol karışımı ile ekstre edilir. Elde edilen solüsyondan maddeler ters faz likit kromatografi ile UV saptaması yolu ile yapılır.
3. REAKTİFLER
3.1. Bütün çözeltiler analitik saflıkta olmalı, kullanılan su distile edilmiş olmalı veya aynı derecede saf su kullanılmalıdır.
3.2. Metanol
3.3. Hidrokinon
3.4. Hidrokinon monometileter
3.5. Hidrokinon monoetileter
3.6. Hidrokinon monobenzileter (monobenzon)
3.7. Tetrahidrofuran, HPLC kalitede
3.8. Su / metanol karışımı 1:1 (v/v): Bir hacim su ile bir hacim metanol (3.2) karıştırılır.
3.9. Mobil faz: Tetrahidrofuran / su karışımı 45:55 (v/v). 45 hacim tetrahidrofuran (3.7) ve 55 hacim su ile karıştırılır.
3.10. Referans solüsyon: 0.06 g hidrokinon (3.3), 0.08 g hidrokinon monometileter (3.4), 0.10 g hidrokinon monoetileter (3.5) ve 0.12 g hidrokinon monobenzileter (3.6), 50 ml.lik ölçülü balona tartılır. Metanol (3.2) ile çözülerek hacme tamamlanır. Bu solüsyonun 10 ml.si, 50 ml’ye su / metanol karışımı (3.8) ile seyreltilerek referans solüsyon hazırlanır. Bu solüsyonlar taze hazırlanmalıdır.
4. EKİPMAN
Normal laboratuvar ekipmanları
4.1. 60oC’de su banyosu
4.2. Değişken dalga boylu UV dedektörlü 10 µl enjeksiyon luplu yüksek basınçlı sıvı kromatografisi
4.3. Analitik kolon
Paslanmaz çelikten kromatografik kolon;
Uzunluk : 250 mm
İç çap : 4.6 mm
Zorbax fenil (kimyasal bağlı feniletilsilan Zorbax SIL, trimetilklorosilan “end capped”) partikül büyüklüğü 6 µm veya eşdeğeri
Fenil veya eşdeğeri hariç başka bir ön kolon kullanılmaz.
4.4. Filtre kağıdı, çap 90 mm, Schleicher and Schull, Weissband No 5892 veya eşdeğeri
5. İŞLEM
5.1. Örnek hazırlanması
1 ± 0.1 g (a gram) sıfırdan sonra üç haneye kadar örnek 50 ml.lik ölçülü balona tartılır. Örnek 25 ml su / metanol (3.8) karışım içinde dağıtılır. Balon kapağı kapatılır ve en az bir dakika homojen süspansiyon elde etmek için şiddetle çalkalanır. 60oC’deki su banyosu (4.1) içine yerleştirilir. Daha sonra su banyosundan çıkartılan balon soğutulur.
Su / metanol (3.8) karışımı ile hacme tamamlanır. Filtre kağıdından (4.4) süzülür. 24 saat içinde HPLC’ye uygulanır.
5.2. Yüksek basınçlı sıvı kromatografisi
5.2.1. Mobil faz (3.9) akış hızı: 1 ml / dakika
Dedektör dalga boyu: 295 nm
5.2.2. 5.1’de elde edilen örnek solüsyondan 10 µl enjekte edilir, kromatogram kaydedilir. Pik alanları ölçülür. 5.2.3’de belirtildiği şekilde kalibrasyon eğrisi çizilir. Örnek ve standart solüsyondan elde edilen kromatogramlar karşılaştırılır. 5.2.3’te hesaplanmış cevap faktörleri ve pik alanları kullanılarak örnek çözeltideki bileşenlerin konsantrasyonları hesaplanır.
5.2.3. Kalibrasyon
Referans solüsyondan (3.10) 10 µl enjekte edilir ve kromatogram kaydedilir. Sabit bir pik alanı elde edinceye kadar enjeksiyon işlemi birkaç kez tekrar edilir.
Cevap faktörü RFi tayin edilir.
| pi | ||
| RFi= | ||
| ci |
Burada:
pi = Hidrokinon, hidrokinon monometileter, hidrokinon monoetileter veya Hidrokinon monobenzileter’in pik alanları
ci = Hidrokinon, hidrokinon monometileter, hidrokinon monoetileter, hidrokinon monobenziletere ait referans solüsyon (3.10) içindeki konsantrasyonu (g / 50 ml)
Standart solüsyon ve örnek solüsyon için elde edilen kromatogramların aşağıdaki şartları yerine getirip getirmediğinden emin olunur.
– En kötü ayrılmış pik çiftinin ayrılması en az 0.90 olmalıdır. (Pik ayırımı tanımı için şekil 1’e bakınız.)
 | |||||||||||||
|
– Eğer istenen ayırım elde edilmemişse ya daha etkili bir kolon kullanılır yada ayırım elde edilinceye kadar mobil fazın bileşimi ayarlanır.
– Elde edilen tüm piklerin asimetri faktörü As 0.9 – 1.5 arasında olmalıdır. (Pik asimetri faktör tanımı için şekil 2’ye bakınız.) Asimetri faktör tayini için kromatogram kaydedilirken kağıt hızının en az 2 cm / dakika olması önemlidir.
 | |||||||||||||
|
6. HESAPLAMA
Örnek içindeki maddelerin konsantrasyonlarını hesaplamak için bileşenlerin piklerinin alanları kullanılır. Bileşen konsantrasyonları aşağıdaki formül kullanılarak yüzde kütle olarak (xi) hesaplanır.
| bi x 100 | |
| xi%(m/m) = | |
| RFi x a |
Burada:
a = Örneğin gram olarak kütlesi
bi = Örnek içindeki bileşenlerin pik alanı
7. TEKRARLANABİLİRLİK (ISO NORM 5725)
7.1. % 2’lik bir hidrokinon miktarı için aynı örnek üzerinde yapılan iki paralel tayin sonucu arasındaki fark % 0.13’ü geçmemelidir.
7.2. % 1’lik bir hidrokinon monometileter miktarı için aynı örnek üzerinde yapılan iki paralel tayin sonucu arasındaki fark % 0.1’i geçmemelidir.
7.3. % 1’lik bir hidrokinon monoetileter miktarı için aynı örnek üzerinde yapılan iki paralel tayin sonucu arasındaki fark % 0.11’i geçmemelidir.
7.4. % 1’lik bir hidrokinon monobenzileter miktarı için aynı örnek üzerinde yapılan iki paralel tayin sonucu arasındaki fark % 0.11’i geçmemelidir.
8. ÜRETİLEBİLİRLİK (ISO 5725)
8.1 % 2’lik bir hidrokinon miktarı için aynı örnek üzerinde değişik şartlarda (değişik laboratuvar, değişik operatör, değişik cihaz ve / veya değişik zamanlarda) yapılan iki farklı tayin değerlendirilir. Aradaki fark % 0.37’i geçmemelidir.
8.2 % 1’lik bir hidrokinon monometileter miktarı için aynı örnek üzerinde değişik şartlarda (değişik laboratuvar, değişik operatör, değişik cihaz ve / veya değişik zamanlarda) yapılan iki farklı tayin değerlendirilir. Aradaki fark % 0.21’i geçmemelidir.
8.3 % 1’lik bir hidrokinon monoetileter miktarı için aynı örnek üzerinde değişik şartlarda (değişik laboratuvar, değişik operatör, değişik cihaz ve / veya değişik zamanlarda) yapılan iki farklı tayin değerlendirilir. Aradaki farkı % 0.19’u geçmemelidir.
8.4 % 1’lik bir hidrokinon monobenzileter miktarı için aynı örnek üzerinde değişik şartlarda (değişik laboratuvar, değişik operatör, değişik cihaz ve / veya değişik zamanlarda) yapılan iki farklı tayin değerlendirilir. Aradaki fark % 0.11’i geçmemelidir.
9. UYARI
9.1 Hidrokinon miktarı % 2’nin bir hayli üzerinde bulunması halinde ve doğru bir ayin yapılmak isteniyor ise, elde edilmiş olan örnek ekstraktı (5.1)% 2’lik hidrokinon elde edilmiş bir örneğinkine benzer şekilde seyreltilmelidir ve tayin tekrarlanmalıdır.
(Bazı cihazlarda yüksek konsantrasyonlarda hidrokinon için dedektör cevabı doğrusallıktan sapabilir.)
9.2 Etkileşmeler
Yukarıda tarif edilen metod hidrokinon ve eterlerinin tek bir izokratik çalışmada tayinini tanımlamaktadır. Fenil kolonunun kullanılması halinde hidrokinon için yeterli tutulma (alıkonma zamanı) sağlanmaktadır. Bu durum tarifi yapılan mobil fazda C18 kolonu kullanıldığında garanti edilmeyebilir.
Bununla beraber bu metod, parabenler tarafından oluşturulan etkileşmelere eğilim göstermektedir. Bu durumlarda başka mobil faz veya faz sistemi ile tayin tekrarlanmalıdır. Referans 1 ve referans 2’de uygun metodlar bulunabilir.
Yani:
Kolon : Zorbax ODS, 4.6 mm x25 mm veya eşdeğeri
Sıcaklık : 36oC
Akış : 1.5 ml / dakika
Mobil faz:
Hidrokinon için : Metanol / su, 5: 95 (v/v)
Hidrokinon monometileter için : Metanol / su, 30:70 (v/v)
Hidrokinon monobenzileter için : Metanol / su, 80: 20 (v/v)
Kolon : Spherisorb S5 – ODS veya eşdeğeri
Mobil faz : Su / metanol 90: 10 (v/v)
Akış : 1.5 ml / dakika
Bu şartlar hidrokinon için uygundur.
Kaynak: IEGM